|
Il fegato è una grossa ghiandola a struttura lobulare annessa all’apparato
digerente. I lobuli sono costituiti da cordoni di cellule (epatociti) e separati
da vasi sanguigni (sinusoidi) a livello dei quali avviene lo scambio di sostanze
nutritive e metaboliche con l’epatocita. Grazie alle sue molteplici funzioni
biochimiche, il fegato svolge un ruolo centrale nell’omeostasi metabolica
dell’organismo. Il vasto repertorio delle funzioni cataboliche ed anaboliche
dell’epatocita sono riassunte nella Fig.3.1. Il
fegato svolge un ruolo fondamentale nella regolazione del metabolismo
glucidico,
lipidico ed amminoacidico, sintetizza l’eme, i corpi chetonici, l’urea, le
proteine plasmatiche e provvede a neutralizzare la tossicità di una varietà di
sostanze xenobiotiche. Possiede una funzione escretoria producendo la bile
che, oltre
ad acqua, elettroliti inorganici, colesterolo, fosfolipidi, contiene anche
acidi biliari, prodotti della degradazione del colesterolo (Fig.3.2),
fondamentali per l’assorbimento dei grassi. Il fegato inoltre provvede in
larga misura alla sintesi del colesterolo e alla degradazione dell’eme con
formazione di bilirubina escreta con la bile nell’intestino (Fig.3.4).
Il fegato mantiene l’omeostasi glucidica dell’organismo, in relazione all’apporto
nutrizionale e alle variazioni metaboliche attraverso: a) formazione di
glicogeno
(glicogeno sintesi); b) rilascio di glucosio dal glicogeno (glicogenolisi);
c) utilizzazione del glucosio (glicolisi, shunt dell’esosomonofosfato, formazione
di acido glucuronico); d) sintesi di glucosio (gluconeogenesi); e) conversione
di glucidi in grassi. La membrana dell’epatocita è permeabile al glucosio il
quale viene convertito in glucosio-6-fosfato ad opera di una glucochinasi
e
segue le vie metaboliche riportate nella Fig.3.6.
La sintesi di glicogeno, un polimero del glucosio in legame ![]() 1-4
glicosidico e ramificato tramite legami
1-4
glicosidico e ramificato tramite legami ![]() 1-6
(Fig.3.7),
necessita di uno stampo di glicogeno preformato a cui si attaccano unità di
glucosio legato all’UDP (Fig.3.8).
La reazione è catalizzata dalla glicogeno sintetasi nella sua forma attiva
non
fosforilata, favorita dalla presenza di insulina (Fig.3.9).
Attraverso un meccanismo AMPc-dipendente il glucagone favorisce
invece l’inattivazione dell’enzima, mentre attiva contemporaneamente la glicogeno
fosforilasi, enzima che catalizza la scissione del glicogeno in unità di
glucosio (Fig.3.10
e Fig.3.11)
e che viene inibito allostericamente dal glucosio stesso, in seguito ad una
aumentata disponibilità da parte dell’epatocita (Fig.3.12).
Una via alternativa al catabolismo del glucosio attraverso la glicolisi, è rappresentata
dallo shunt dell’esosomonofosfato (Fig.3.13)
o ciclo dei pentosi, che produce sia potere riducente sotto forma di NADPH,
necessario nel fegato per la sintesi riduttiva di acidi grassi e di steroidi
a partire dall’acetil-CoA, che pentosi (specie ribosio) richiesti per la
sintesi di nucleotidi e di coenzimi (CoASH, NAD+, NADP+,
FMN) e che può portare anche all’ossidazione completa di glucosio-6P a
CO2.
Attraverso il processo della gluconeogenesi, il fegato è in grado di convertire
materiale non glucidico in glucosio (Fig.3.14),
con l’ausilio di alcuni enzimi specifici che rendono reversibile la via glicolitica
(Fig.3.15
e Fig.3.16).
Gluconeogenesi e glicolisi sono controllate bidirezionalmente dal fruttoso
2,6
bisfosfato (Fig.3.17),
la cui funzione è regolata dal glucagone (Fig.3.18).
Il ruolo del fegato nel metabolismo lipidico è riassunto nella Fig.3.19.
La biosintesi di acidi grassi avviene nell’epatocita utilizzando come fonti
di carbonio il glucosio in eccesso proveniente dalla dieta, ma anche fruttosio
e lattato, previa conversione in acido piruvico che, a livello mitocondriale,
viene trasformato in acetil-CoA, il precursore della sintesi di acidi grassi
(Fig.3.20).
Il trasferimento di acetil-CoA nel citosol, sede del processo di sintesi,
avviene
sotto forma di acido citrico e richiede acido ossalacetico che, liberato nel
citosol, genera acido malico il quale, trasformandosi in acido piruvico genera
NADPH necessario alla sintesi di acidi grassi. Quest’ultima, che vede inizialmente
la carbossilazione di acetil-CoA in malonil-CoA in presenza di biotina (Fig.3.21), è catalizzata dall’acido
grasso sintetasi, un complesso di sette attività enzimatiche
contenente tre distinti dominii (Fig.3.22),
che porta alla formazione finale di acido palmitico attraverso sei cicli
di
allungamento le cui fasi sono riportate nella Fig.3.23.
Acidi grassi a più lunga catena possono generarsi a livello del reticolo
endoplasmico per azione di enzimi microsomiali. Sistemi microsomiali sono
anche responsabili
della formazione di acidi grassi insaturi (Fig.3.24).
Gli acidi grassi epatici sono utilizzati per la sintesi di trigliceridi (Fig.3.26)
che vengono poi veicolati agli altri tessuti sotto forma di complessi lipoproteici
costituiti oltre che da trigliceridi anche da colesterolo e fosfolipidi. Tali
complessi, detti lipoproteine a densità molto bassa o VLDL, possono essere
successivamente metabolizzate ad opera di una lipoproteina lipasi per dare
origine alle LDL
(lipoproteine a bassa densità) particolarmente ricche di colesterolo (Fig.3.27).
Oltre alle VLDL il fegato sintetizza anche HDL (lipoproteine ad alta densità) che,
grazie ad una lecitina-colesterolo-aciltransferasi presente sulla loro superficie
sono in grado, un volta in circolo, di incorporare il colesterolo
presente nei tessuti e di trasportarlo al fegato (Fig.3.28).
1-6
(Fig.3.7),
necessita di uno stampo di glicogeno preformato a cui si attaccano unità di
glucosio legato all’UDP (Fig.3.8).
La reazione è catalizzata dalla glicogeno sintetasi nella sua forma attiva
non
fosforilata, favorita dalla presenza di insulina (Fig.3.9).
Attraverso un meccanismo AMPc-dipendente il glucagone favorisce
invece l’inattivazione dell’enzima, mentre attiva contemporaneamente la glicogeno
fosforilasi, enzima che catalizza la scissione del glicogeno in unità di
glucosio (Fig.3.10
e Fig.3.11)
e che viene inibito allostericamente dal glucosio stesso, in seguito ad una
aumentata disponibilità da parte dell’epatocita (Fig.3.12).
Una via alternativa al catabolismo del glucosio attraverso la glicolisi, è rappresentata
dallo shunt dell’esosomonofosfato (Fig.3.13)
o ciclo dei pentosi, che produce sia potere riducente sotto forma di NADPH,
necessario nel fegato per la sintesi riduttiva di acidi grassi e di steroidi
a partire dall’acetil-CoA, che pentosi (specie ribosio) richiesti per la
sintesi di nucleotidi e di coenzimi (CoASH, NAD+, NADP+,
FMN) e che può portare anche all’ossidazione completa di glucosio-6P a
CO2.
Attraverso il processo della gluconeogenesi, il fegato è in grado di convertire
materiale non glucidico in glucosio (Fig.3.14),
con l’ausilio di alcuni enzimi specifici che rendono reversibile la via glicolitica
(Fig.3.15
e Fig.3.16).
Gluconeogenesi e glicolisi sono controllate bidirezionalmente dal fruttoso
2,6
bisfosfato (Fig.3.17),
la cui funzione è regolata dal glucagone (Fig.3.18).
Il ruolo del fegato nel metabolismo lipidico è riassunto nella Fig.3.19.
La biosintesi di acidi grassi avviene nell’epatocita utilizzando come fonti
di carbonio il glucosio in eccesso proveniente dalla dieta, ma anche fruttosio
e lattato, previa conversione in acido piruvico che, a livello mitocondriale,
viene trasformato in acetil-CoA, il precursore della sintesi di acidi grassi
(Fig.3.20).
Il trasferimento di acetil-CoA nel citosol, sede del processo di sintesi,
avviene
sotto forma di acido citrico e richiede acido ossalacetico che, liberato nel
citosol, genera acido malico il quale, trasformandosi in acido piruvico genera
NADPH necessario alla sintesi di acidi grassi. Quest’ultima, che vede inizialmente
la carbossilazione di acetil-CoA in malonil-CoA in presenza di biotina (Fig.3.21), è catalizzata dall’acido
grasso sintetasi, un complesso di sette attività enzimatiche
contenente tre distinti dominii (Fig.3.22),
che porta alla formazione finale di acido palmitico attraverso sei cicli
di
allungamento le cui fasi sono riportate nella Fig.3.23.
Acidi grassi a più lunga catena possono generarsi a livello del reticolo
endoplasmico per azione di enzimi microsomiali. Sistemi microsomiali sono
anche responsabili
della formazione di acidi grassi insaturi (Fig.3.24).
Gli acidi grassi epatici sono utilizzati per la sintesi di trigliceridi (Fig.3.26)
che vengono poi veicolati agli altri tessuti sotto forma di complessi lipoproteici
costituiti oltre che da trigliceridi anche da colesterolo e fosfolipidi. Tali
complessi, detti lipoproteine a densità molto bassa o VLDL, possono essere
successivamente metabolizzate ad opera di una lipoproteina lipasi per dare
origine alle LDL
(lipoproteine a bassa densità) particolarmente ricche di colesterolo (Fig.3.27).
Oltre alle VLDL il fegato sintetizza anche HDL (lipoproteine ad alta densità) che,
grazie ad una lecitina-colesterolo-aciltransferasi presente sulla loro superficie
sono in grado, un volta in circolo, di incorporare il colesterolo
presente nei tessuti e di trasportarlo al fegato (Fig.3.28).
La degradazione degli acidi grassi (substrati energetici preferenziali dell’epatocita)
ha luogo nel mitocondrio attraverso il processo di ![]() -ossidazione che libera
progressivamente acetil-CoA accompagnato dalla formazione di FADH2
e NADH destinati alla catena respiratoria per la produzione di ATP (Fig.3.29).
Gli acetil-CoA entrano nel ciclo di Krebs per essere ossidati a CO2
e H2O, mentre la quota in eccesso può dare origine ai corpi chetonici
(acido acetoacetico,
-ossidazione che libera
progressivamente acetil-CoA accompagnato dalla formazione di FADH2
e NADH destinati alla catena respiratoria per la produzione di ATP (Fig.3.29).
Gli acetil-CoA entrano nel ciclo di Krebs per essere ossidati a CO2
e H2O, mentre la quota in eccesso può dare origine ai corpi chetonici
(acido acetoacetico, ![]() -ossibutirrico e acetone) che vengono liberati in
circolo in quanto il fegato non può utilizzarli (Fig.3.30)
a differenza di altri tessuti quali cuore, muscolo, cervello e rene (Fig.3.31).
La chetogenesi è particolarmente attiva in tutte le condizioni che portano ad
una scarsa disponibilità di acido ossalacetico e l’accumulo di corpi chetonici
nel sangue (chetonemia) può portare all’acidosi con depauperamento della riserva
alcalina. Gli acetil-CoA sono anche precursori della biosintesi di colesterolo
che avviene nel citosol dell’epatocita (Fig.3.32)
e richiede NADPH, ATP e O2. Il processo è inibito dal colesterolo
stesso, mentre è favorito da insulina e ormoni tiroidei. Il colesterolo è in
gran parte convertito in acidi biliari e/o messo in circolo con le lipoproteine
e rappresenta il precursore di cinque classi di ormoni steroidei (Fig.3.33).
Infine il fegato è sede della formazione e dell’interconversione di fosfolipidi.
La sintesi richiede o l’attivazione di specifiche basi azotate sotto forma di
CDP-derivati (Fig.3.34)
che si condensano all’1-2 digliceride (Fig.3.35)
o l’attivazione di quest’ultimo sotto forma di CDP-digliceride sul quale si
esterificano composti quali la serina, l’inositolo o il glicerolo fosfato (Fig.3.36).
-ossibutirrico e acetone) che vengono liberati in
circolo in quanto il fegato non può utilizzarli (Fig.3.30)
a differenza di altri tessuti quali cuore, muscolo, cervello e rene (Fig.3.31).
La chetogenesi è particolarmente attiva in tutte le condizioni che portano ad
una scarsa disponibilità di acido ossalacetico e l’accumulo di corpi chetonici
nel sangue (chetonemia) può portare all’acidosi con depauperamento della riserva
alcalina. Gli acetil-CoA sono anche precursori della biosintesi di colesterolo
che avviene nel citosol dell’epatocita (Fig.3.32)
e richiede NADPH, ATP e O2. Il processo è inibito dal colesterolo
stesso, mentre è favorito da insulina e ormoni tiroidei. Il colesterolo è in
gran parte convertito in acidi biliari e/o messo in circolo con le lipoproteine
e rappresenta il precursore di cinque classi di ormoni steroidei (Fig.3.33).
Infine il fegato è sede della formazione e dell’interconversione di fosfolipidi.
La sintesi richiede o l’attivazione di specifiche basi azotate sotto forma di
CDP-derivati (Fig.3.34)
che si condensano all’1-2 digliceride (Fig.3.35)
o l’attivazione di quest’ultimo sotto forma di CDP-digliceride sul quale si
esterificano composti quali la serina, l’inositolo o il glicerolo fosfato (Fig.3.36).
Attraverso i processi di digestione e assorbimento delle proteine della dieta arrivano al fegato principalmente amminoacidi liberi che il fegato può immagazzinare o convertire in proteine. Il fegato pertanto presiede a tutti i processi del catabolismo o conversione degli amminoacidi attraverso i quali si ha liberazione di CO2, NH3, H2O e urea, produzione di nuove proteine, amminoacidi o composti diversi come zuccheri, lipidi, acidi nucleici. Alcuni amminoacidi possono essere anche convertiti in metaboliti particolari quali porfirine, poliammine, purine. Il processo che dà inizio al catabolismo amminoacidico è la transaminazione (Fig.3.38) o trasferimento di un gruppo aminico da un aminoacido ad un chetoacido, con formazione di un nuovo amminoacido e di un nuovo chetoacido. La reazione richiede piridossal-fosfato al quale viene trasferito il gruppo aminico, con formazione di una base di Schiff, e può terminare con un processo di deaminazione dell’amminoacido. I chetoacidi prodotti possono essere ossidati o trasformati in intermedi del metabolismo glucidico o lipidico (Fig.3.39). Il catabolismo degli aminoacidi produce ammoniaca, sostanza molto tossica che deve essere prontamente eliminata. Nelle cellule dei tessuti extraepatici l’ammoniaca è rimossa da reazioni che portano alla sintesi di glutammato o glutammina Nel fegato la maggior parte dell’ ammoniaca è convertita in urea, sostanza azotata meno tossica, specie per il sistema nervoso centrale. La prima reazione della sintesi dell’urea avviene nel mitocondrio della cellula epatica e porta alla formazione di carbamilfosfato a partire da ioni ammonio, CO2, ATP (Fig.3.42). È una reazione irreversibile catalizzata dall’enzima carbamilfosfato sintetasi la cui velocità dipende dalla disponibilità dei precursori. Il carbamilfosfato si condensa successivamente con una molecola di ornitina dando origine a citrullina che passa nel citoplasma per essere ulteriormente metabolizzata ad urea (Fig.3.43).
Il fegato presiede anche alla rimozione di svariate sostanze "non nutritive" presenti nell’organismo riducendone o annullandone l’eventuale tossicità. Le reazioni di biotrasformazione di farmaci, ormoni steroidei, steroidi endogeni e sostanze tossiche, comprendono processi di detossicazione esplicati mediante idrossilazioni, ossidazioni, riduzioni e coniugazioni che avvengono principalmente nei microsomi del fegato. Le reazioni di idrossilazione (Fig.3.45) sono catalizzate da monoossigenasi o idrossilasi che utilizzano il NADPH come donatore di equivalenti riducenti. L’enzima catalizza l’incorporazione di un atomo di ossigeno dall’O2 nel substrato da idrossilare, mentre il secondo atomo di ossigeno viene ridotto ad H2O dal NADPH. Il trasferimento di elettroni dal NADPH al substrato ridotto è mediato dal citocromo P450, un’emoproteina particolarmente abbondante nei microsomi del fegato. Prodotto intermedio del sistema ossigenasi-citocromo P450 è rappresentato dall’anione superossido O2•- generato per riduzione parziale da O2. I radicali superossido a loro volta danno origine, per dismutazione spontanea o catalizzata dalla superossidodismutasi (SOD) ad H2O2 (Fig.3.47), con la quale possono reagire dando origine al radicale ossidrile •OH, una specie altamente ossidante capace di interagire con una grande varietà di composti organici, dando luogo a radicali secondari. Nel fegato la detossicazione dell’ H2O2 oltre che ad opera della catalasi dei perossisomi, avviene anche ad opera di perossidasi tra le quali la glutatione perossidasi (Fig.3.48). L’azione congiunta di SOD, catalasi e perossidasi limita la formazione del radicale ossidrile •OH prevenendo così i danni cellulari da esso indotti e costituendo perciò un valido meccanismo di difesa contro la tossicità dell’O2. Nelle reazioni di riduzione, gruppi nitrosi sono ridotti alle corrispondenti amine utilizzando sia il sistema NADPH-citocromo P450 reduttasi sia il citocromo P450. Le reazioni di coniugazione (Tab.3.1) consistono nella combinazione di sostanze non fisiologiche o xenobiotiche con gruppi polari per formare un coniugato inattivo più facilmente eliminabile dal rene.
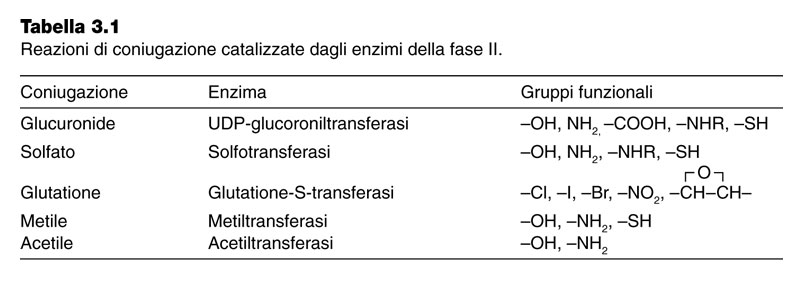
Le principali reazioni di questo tipo sono: 1) la coniugazione di composti come fenoli, alcooli, acidi carbossilici, amine e tioli con acido glucuronico con formazione di glucuronidi (Fig.3.49); 2) la coniugazione di fenoli, alcooli, amine con solfati per dare origine a esteri solfati assai solubili in acqua (Fig.3.50); 3) l’acetilazione di amino composti catalizzata dall’acetiltransferasi; 4) la metilazione di alcuni fenoli, catecolamine e di acido nicotinico a spese della metionina; 5) l’attacco di glicina ad acidi aromatici quali l'acido benzoico o l'acido salicilico con formazione di un’amide sostituita (Fig.3.51); 6) l’attacco di glutatione a composti alogenati e a nitrocomposti come il 2-4 dinitro-1-clorobenzene per formare un coniugato attraverso il legame con l’atomo di zolfo del residuo di cisteina (Fig.3.52).
L’etanolo, un alcool con elevato contenuto energetico viene metabolizzato per l’80% dal fegato e in misura minore nella mucosa gastrica e nel rene. La prima tappa del metabolismo dell’etanolo è la sua ossidazione ad acetaldeide, reazione catalizzata dall’alcool deidrogenasi NAD+-dipendente. L’acetaldeide viene successivamente trasformata in acido acetico ad opera di un’acetaldeide deidrogenasi NAD+-dipendente e quindi in acetilCoA (Fig.3.53), ossidato a CO2 nel ciclo di Krebs. Nel fegato sono presenti altri due enzimi in grado di trasformare l’etanolo in acetaldeide che sono attivi solo ad elevata concentrazione di alcool: la catalasi, che utilizzando H2O2 ha anche un ruolo detossificante e l’alcool idrossilasi a funzione mista (MEOS), che utilizza O2 e NADPH e costituisce il sistema microsomiale ossidante dell’etanolo. Il MEOS è un sistema aspecifico in grado di catalizzare anche la detossicazione di molti farmaci o composti tossici. In caso di elevato apporto di etanolo avvengono, nell’epatocita, cambiamenti nella concentrazione di alcuni cofattori dovuti all’elevata ossidazione dell’alcool. Tra questi aumenta il rapporto NADH/NAD+ e di conseguenza si osserva uno spostamento del potenziale redox verso uno stato più ridotto, condizione che determina variazioni nel rapporto di substrati NAD dipendenti (Tab.3.2).
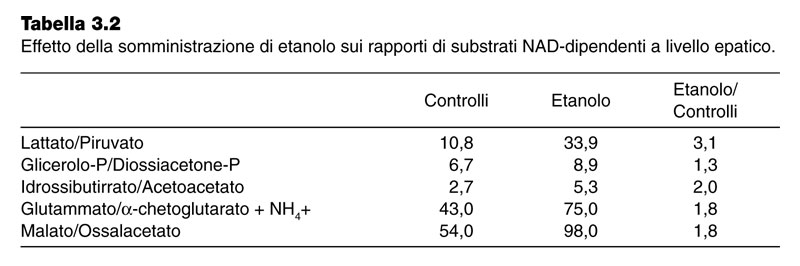
Ciò porta ad un aumento della sintesi di acidi grassi e trigliceridi. Questi ultimi in parte si accumulano causando steatosi e in parte vengono trasportati in circolo sotto forma di VLDL (Fig.3.54). L’aumento della sintesi di lipidi è anche associato ad un incremento della chetogenesi e della colesterologenesi. L’alterazione del potenziale redox dell’epatocita determina inoltre un’inibizione del ciclo di Krebs e dell’ossidazione degli acidi grassi, una riduzione della gluconeogenesi, una diminuita possibilità di eliminare acido urico. Durante il metabolismo dell’etanolo si formano inoltre radicali liberi dell’ossigeno e il radicale idrossietilico, responsabili entrambi dell’aumento dei processi di perossidazione lipidica e di una riduzione delle difese antiossidanti del fegato (Fig.3.55). Queste alterazioni sono correlate con l’eziopatogenesi delle patologie epatiche causate dall’alcool quali steatosi, necrosi, infiammazione e fibrosi.
vai a: Quiz Capitolo 3